LcDNA在CGT领域中的应用开发2023年12月8日 基因递送技术是将外源遗传物质定点递送至靶细胞、靶器官或靶组织中并进行表达的技术,是基因药物研发过程中的关键技术之一。目前用于基因疗法的载体主要分为两大类:病毒载体和非病毒载体,选择哪种递送系统取决于靶细胞及其特性、表达时间和目的基因大小。就非病毒载体来说,其细胞毒性、免疫原性和致突变性较低,载体容量大,且具有材料来源广泛、化学结构可控、易于大规模制备、所携带的目的基因不整合至宿主细胞基因组等优势。 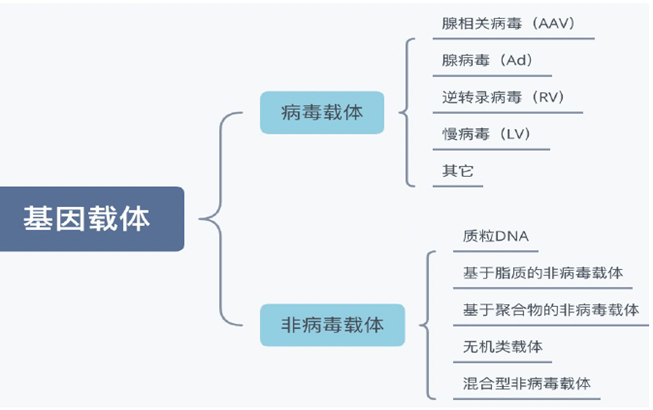 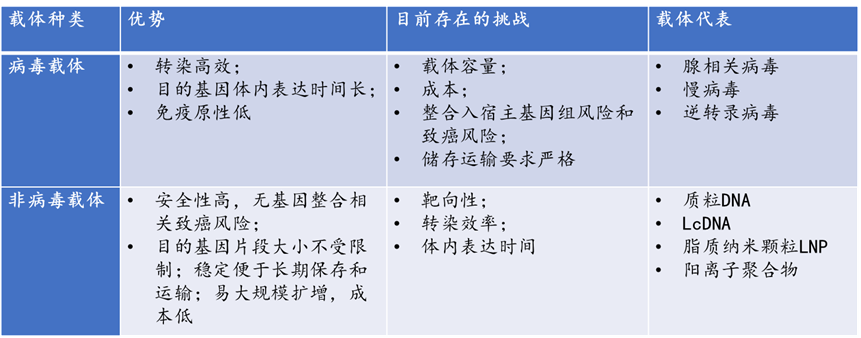 表1. 病毒载体和非病毒载体的对比
本期基因递送载体,我们将为您介绍非病毒载体 LcDNA 在细胞基因治疗领域中的工艺开发应用。
LcDNA (Linear closed end DNA),即线性闭合末端DNA,在两端具有自由的、非连接的3' 和5' 末端,是一种小的、线性双链共价闭合DNA 结构,因其形状类似于“狗骨头”(doggybone),也被称为dbDNA。将 LcDNA 导入目标细胞中,可实现对细胞内特定基因的引入和表达,常用于基因功能研究和基因药物开发。LcDNA 在临床应用及安全性上有较大优势,但工艺开发难,生产成本大,想要获得高表达量、高纯度、低杂质残留的 LcDNA 并非易事。
 图2. LcDNA 模式图
LcDNA 工艺开发难点及应对策略
LcDNA 不携带骨架信息,仅表达目的基因,分子量小,细胞转染效率高。但往往因为平台技术不成熟、参数优化难、体系放大一致性差、工艺开发生产转化难,而导致LcDNA 工艺开发和生产困难重重。
不同于传统的用于病毒包装的DNA 载体, LcDNA 生产一般采用DNA 合成技术,即使用酶促反应原理进行规模化生产,生产快、产品纯度高。但与传统细菌发酵生产质粒DNA 载体的方法相比,成本较高。药明生基通过质粒开发平台上下游优势,根据产品特性进行实验设计,获取足够的原材料后再进行酶法制备,使得上游表达量和下游层析收率均可满足产能需求,显著降低生产成本。
 图4. LcDNA 工艺设计与优化 药明生基质粒上游开发,基于可授权的高表达菌株库,根据不同的产品类型筛选不同菌株进行扩增、培养基优化、发酵控制、补料策略等多种开发手段协同使用,以便达到高表达量的实验目的。通过单克隆筛选高表达量菌株进行高密度发酵,使得上游表达量提升至1000mg/L左右。在工艺转移上,无论是小试阶段还是生产规模,均展现出良好的一致性和稳健性。 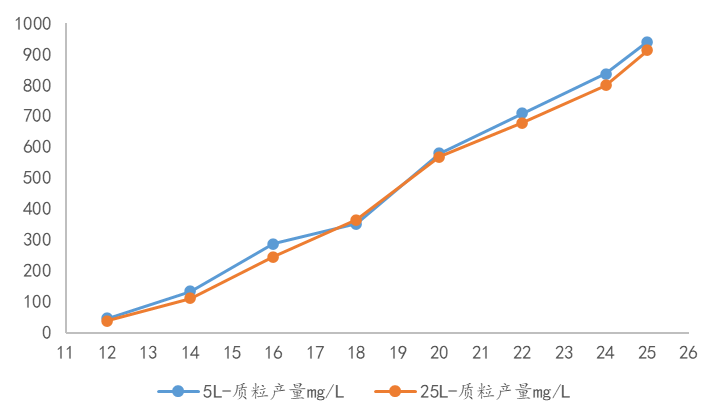 图5. 药明生基LcDNA 平台工艺放大一致性
下游两步层析——质量和回收率的保障
不管是LcDNA,还是用于构建病毒载体的质粒,药明生基均具有丰富的工艺开发和生产经验。截至目前,药明生基已成功交付GMP质粒240+批次,拥有3条GMP生产线(5L~50L~200L)和1条GMP灌装线(可根据客户需求,支持75µL-100mL等不同规格的质粒产品灌装),实现年产60批,单批次质粒产量最高可达30g。
LcDNA下游工艺通过两步层析策略,使得回收率大大提高,不同规模的总回收率均超过了40%(图6),且杂质含量符合工艺要求(图7),无论产品质量及回收率上具有一致性和稳健性。

药明生基质粒放行检测
药明生基质粒检测涵盖理化性质、鉴别、质粒纯度、安全性、杂质残留(HCDHCPHCR)等多个维度,从开发批到GMP生产批检测方法良好衔接,使得工艺具有一致性。除此之外,我们还可提供长期稳定性研究、使用稳定性研究、冻融稳定性研究、加速稳定性研究等,满足后续申报需求。 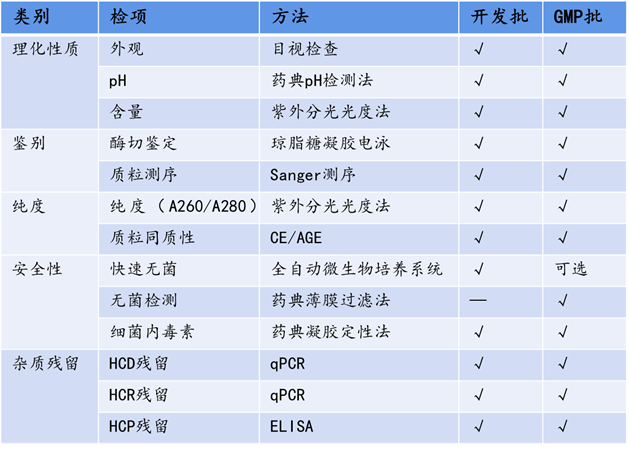 表2. 药明生基质粒放行检测项 |
