一键获取 │ 全球AAV 疗法【管线/融资】(附:近期AAV 疗法行业动态)
腺相关病毒载体(Adeno-associated Virus, AAV)是目前常用的基因疗法载体,可将治疗基因体内递送至患者靶组织/细胞,常通过基因替代、基因沉默、递送新基因、基因编辑等方式来实现遗传性疾病的治疗,如中枢神经系统、视网膜退行性疾病、各种类型的肌肉萎缩症以及心脏、肺和肝脏疾病等。
AAV 的基因组结构
AAV属于细小病毒科依赖细小病毒属,由直径约26 nm的二十面体蛋白衣壳和约4.7 kb的单链DNA基因组组成,衣壳由VP1、VP2和VP3三种亚基组成,共60个拷贝,比例是1:1:10 (VP1:VP2:VP3)。基因组两侧有两个T形末端反向重复序列(Inverted Terminal Repeats, ITR),是病毒复制和包装信号的起点。AAV基因组主要由rep基因和cap基因构成,rep基因编码病毒复制所需的4种蛋白质:Rep78, Rep68, Rep52和Rep40。cap基因通过不同起始密码子的选择性剪接和翻译来编码三个衣壳亚单位。
用于体内基因递送的是改造后的重组型AAV载体rAAV,即基因组中rep和cap基因被剔除,仅保留了ITRs序列。rep和cap基因的位置被需要递送的基因及表达调控元件所替代,最大装载量不超过5kb,因此需仔细设计有效载荷,充分考虑目的基因序列和所需的调控元件(如启动子和多聚腺苷化信号等)。与AAV载体复制和装配相关的rep、cap基因元件及腺病毒辅助基因元件被分别克隆到其它两种质粒载体上,因此重组AAV载体的制备需要通过三质粒同时转染HEK293细胞。与野生型AAV相比,改造后的rAAV载体装载量提高且体内免疫原性和毒性大幅度降低。
多种血清型,靶向特定器官/组织/细胞
AAV对靶细胞的感染效率和扩散能力,就取决于其衣壳蛋白和靶细胞表面受体之间的相互作用,不同血清型的衣壳结构不同,其组织趋向性和免疫原性不同。目前AAV 已有十几种血清型,其中AAV2、AAV5、AAV8和AAV9型应用较多,主要集中在神经、眼科等领域。已上市的AAV 药物中多为2型、5型和9型,如Roctavian和Hemgenix 为5型,通过静脉注射治疗血友病;Upstaza和Luxturna为2型,Luxturna通过视网膜下注射用于RPE65基因突变导致视力丧失但保留有足够数量的存活视网膜细胞的遗传性视网膜营养不良的儿童和成人患者的治疗,Upstaza通过脑内注射用于18个月及以上芳香族L-氨基酸脱羧酶 (AADC) 缺乏症患者的治疗;Zolgensma为9型,用于2岁以下脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)患者的治疗。
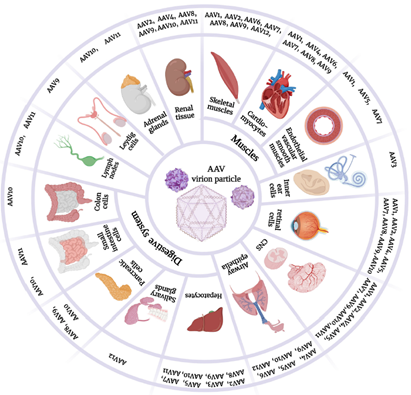
Fig1. AAV不同血清型的感染倾向性
来源:doi: 10.3390/cells12050785
在研管线适应症多为罕见病和神经系统疾病。74% 管线处于临床前
2018年至2022年,以AAV为载体的临床试验注册数量达120项,比1998年至2007年共22项临床试验增加了6倍。截止目前,全球基于AAV 载体的基因疗法管线(积极状态)共780个,适应症集中在血液病,神经系统疾病和眼科疾病领域等。从融资角度看,2023年度全球基因疗法融资总额超60亿美元,总体和2022年度基本持平,美国仍是期间融资事件发生数量最多的国家,占比66%,中国占比17%。
2023年AAV疗法收获颇丰,多款AAV 药物获得上市批准。2023年6月Roctavian和Elevidys在美国获批上市,2024年1月,辉瑞基因疗法Beqvez(fidanacogene elaparvovec)在加拿大获批上市,用于治疗18岁及以上中度至重度B型血友病且对AAV血清型Rh74的中和抗体检测为阴性的成年患者。
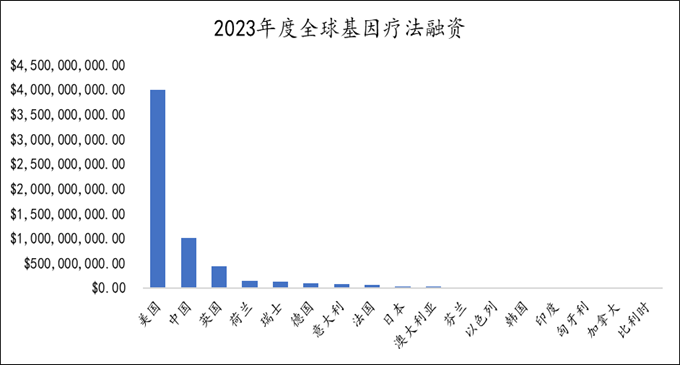
Fig2. 全球基因疗法领域融资概况
数据来自即刻药数数据库,药明生基制图
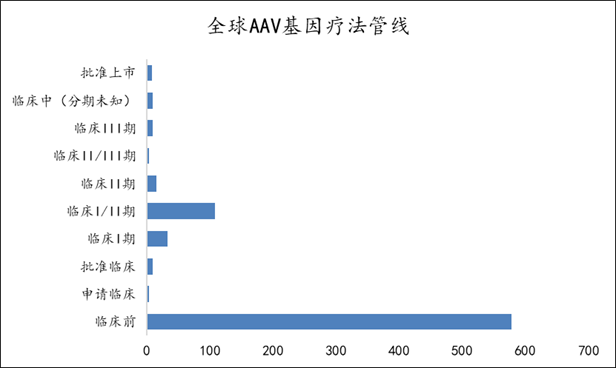
Fig3. 全球AAV 基因疗法管线进展(以全球最高状态为维度,数据截止到2024年1月)
数据来自Insight 数据库,药明生基制图
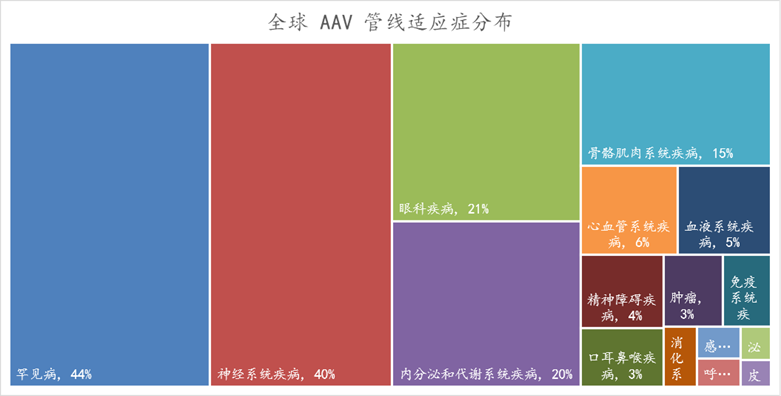
Fig4. 全球AAV 基因疗法管线适应症分布(数据截止到2024年1月)
数据来自Insight 数据库,药明生基制图
当前AAV载体的临床试验呈指数增长,且在临床上已取得了显著进展,包括应用领域不断拓展、治疗效果的不断提升、治疗方案的不断创新等,但仍需要面对多项挑战,如需要大规模的生产质粒、成本、载体质量控制和检测的标准化、体内递送时的免疫屏障等。
充分利用AAV新一代精准基因疗法,并持续改进AAV载体的设计开发,实现体内的精准递送进而降低剂量和成本,综合药物开发的多学科交叉应用,克服当前的挑战,开发创新型药物,这将重新定义基因疗法未来。
作为全球化的CGT CTDMO,药明生基具有AAV三质粒瞬转系统和TESSATM(Tetracycline-Enable Self-Silencing Adenovirus)创新型下一代生产系统双技术平台,三质粒瞬转系统适合早期研发制备和小品种生产,TESSATM 系统适合中到大品种生产,满足客户从药物研发到商业化生产的不同阶段的需求。三质粒瞬转系统采用具有自主知识产权的高性能稳定细胞株HEK293及现货供应包装质粒,平台工艺标准化,适用于不同血清型AAV,缩短开发周期;成熟的悬浮工艺(无血清)生产易于放大,无动物源,降低了生物安全风险,自动化封闭式工艺易于监控,工艺稳健且控制能力高。
附:近期AAV基因疗法行业管线动态汇总
辉瑞血友病基因疗法获批上市,只需一针,显著减少患者出血[1-2]
近日,辉瑞基因疗法Beqvez(fidanacogene elaparvovec)获加拿大卫生部(Health Canada)批准其上市,用于治疗18岁及以上中度至重度B型血友病且对AAV血清型Rh74的中和抗体检测为阴性的成年患者。根据辉瑞新闻稿,Beqvez是一种基于腺相关病毒的体内基因治疗药物,含有生物工程化的AAV衣壳和FIX基因的高活性变体,该基因在B型血友病患者中发生突变,Beqvez设计为一次性治疗,可通过静脉输注将治疗基因靶向递送到人体目标组织器官,使患者能够产生自体FIX蛋白,不需要像目前的标准治疗那样定期静脉输注FIX。Beqvez在美国与欧洲的上市申请已获受理,PDUFA日期为2024年第二季度。Beqvez在加拿大的批准,以及在美国和欧洲的上市申请,都是基于一项临床III期BENEGENE-2研究,根据辉瑞在2022年12月公布的BENEGENE-2数据,该基因疗法使患者的ABR降低了71%,年化凝血因子输注率降低了92%。
截止目前,已获批上市的血友病AAV 疗法共3款,包括2022年8月首次获批的Roctavian和2022年11月获批的Hemgenix,售价分别为290万美元和350万美元。
Taysha Gene Therapies 基因疗法TSHA-102在REVEAL 1/2临床试验中完成了首例Rett综合征患儿治疗[7]
2024年1月10日, Taysha Gene Therapies, Inc. (Nasdaq: TSHA)宣布,在美国进行的REVEAL 1/2临床试验中,首位患儿已接受了TSHA-102治疗。根据Taysha Gene Therapies 新闻稿,REVEAL 1/2期是一项开放标签、随机、剂量递增和扩大剂量的临床试验,旨在评估TSHA-102在5-8岁的因MECP2功能缺失突变引起的雷特综合症女性患者中的安全性和初步有效性,Taysha Gene Therapies预计将在2024年中期完成该儿科临床试验的队列1(低剂量)给药,并报告初步的安全性和有效性数据。TSHA-102是一种经鞘内递送的AAV9基因转移疗法,利用一种新型的miRNA响应性自动调节元件(miRARE)技术以调节神经系统细胞中MECP2的表达水平,避免过度表达。
4DMT与Arbor Biotechnologies建立合作伙伴关系,共同开发和商业化治疗中枢神经系统疾病的下一代基因编辑药物[6]
2024年1月3日,生物科技公司4D Molecular Therapeutics(4DMT)与生物技术公司Arbor Biotechnologies(Arbor)达成合作,目标是共同开发和商业化基于AAV的基因编辑疗法,应对中枢神经系统疾病患者的高度医疗需求。根据4DMT 新闻稿,合作的焦点在于开发最多六种基于CRISPR/Cas的AAV递送治疗药物,首个候选药物将被用于治疗肌萎缩侧索硬化(ALS)。Arbor将负责首个产品的研究、开发和商业化工作,4DMT则将负责第二个候选产品的相关事宜。Arbor的专利基因组编辑技术以其紧凑的体积和高度特异性的递送机制获得了关注。而4DMT则积极运用其自有的治疗性载体进化平台,开发能够靶向各种CNS组织的定制AAV载体。这一合作被视为两家基因药物公司之间的重要策略合作。
AskBio AAV疗法治疗帕金森病的Ib期试验达到主要终点[3]
2024年1月5日,拜耳公司及其全资子公司Asklepios BioPharmaceutical(AskBio)宣布,在研基因疗法AB-1005(AAV2-GDNF)在1b期临床试验中达到主要终点,根据AskBio新闻稿,在11名接受治疗的帕金森患者中,通过一次性双侧对流增强给药,AB-1005表现出良好的安全性和耐受性。AskBio计划在2024年第二季度的行业会议上展示18个月的研究数据,包括次要终点。公司将于2024年上半年启动2期临床试验。
中国首个针对戈谢I型的基因治疗药物完成首例患者给药,有望实现一次给药终身受益[4]
近期,凌意生物宣布,国内首个治疗戈谢I型的基因药物临床研究项目——“LY-M001注射液单次静脉输注给药治疗戈谢病I型成人患者的安全性和初步有效性的前瞻性、单中心、开放、单臂研究”在浙江大学医学院附属第一医院顺利启动。根据凌意生物新闻稿,LY-M001以重组腺相关病毒rAAV为载体,通过单次静脉输注给药后表达葡萄糖脑苷脂酶,可在患者体内长期稳定表达并降解有害糖脂代谢物,从而达到长期治疗戈谢病的目标。2024年1月,LY-M001注射液的新药临床试验(Investigational New Drug,IND)申请先后获国家药品监督管理局(NMPA)和美国食品药品监督管理局(FDA)许可。
信念医药成功完成A型血友病基因疗法注册临床首例受试者给药
2024年1月3日,信念医药集团(Belief BioMed,BBM)(下称"信念医药")自主研发和生产的BBM-H803 注射液的注册临床研究(CTR20233400)在中国完成首例受试者给药。根据信念医药新闻稿,本研究旨在评估BBM-H803注射液单次静脉输注在≥18岁的重度A型血友病患者中的安全性、耐受性和有效性。根据信念医药新闻稿,BBM-H803注射液采用了肝靶向性血清型和高效基因表达盒和工程化衣壳,免疫原性较低,肝脏递送效率较高,通过静脉给药将凝血因子Ⅷ基因导入A型血友病患者体内,从而提高并长期维持患者体内凝血因子水平,以期达到“一次给药、长期有效”的预防出血的效果。
中国首个针对成人晚发型庞贝病的AAV基因替代疗法临床研究在华山医院启动[5]
2023年12月29日,CRG003注射液治疗成人晚发型庞贝病的临床研究启动会在复旦大学附属华山医院顺利举行。这是一项单臂、开放性、单次给药的临床研究,旨在评估单次静脉输注CRG003注射液在≥18岁的晚发型庞贝病患者中的安全性、耐受性和有效性。CRG003注射液是一种基于重组AAV技术的基因替代治疗药物,将优化的基因表达盒递送至肝细胞内并持续合成活性蛋白,有望改善晚发型庞贝病患者的临床症状。
药明生基作为药明康德旗下专注于细胞和基因疗法的CTDMO,致力于加速和变革细胞和基因疗法及其他高端疗法的研究、开发、测试、生产和商业化。药明生基持续加强细胞及基因疗法CTDMO服务平台建设,截止2023年第三季度,为总计68个项目提供了工艺开发、检测与生产服务。药明生基已助力客户完成一个将成为世界首个创新肿瘤淋巴细胞疗法(TIL)项目的FDA上市许可申请(BLA),并且美国费城设施顺利通过FDA药品上市批准前检查(PLI)。已助力客户完成一个CAR-T细胞治疗的慢病毒载体(LVV)项目的BLA,成为中国首家通过国家药品监督管理局食品药品审核查验中心(CFDI) LVV注册现场核查的CGT CDMO,目前该产品已于2023年 11月8日获国家药品监督管理局(NMPA)新药上市申请(NDA)批准。另外,公司完成一项生产重磅商业化 CAR-T 产品的技术转移正在进行工艺验证,预计将在2024年上半年向FDA递交申请。2023年6月,公司与一家大客户签订一项商业化CAR-T产品的LVV生产订单,预计将在2024年上半年开始生产。
|
